Saf Madde Örnekleri: Saf Maddenin Tanımı ve Örnekleri
Saf madde, yalnızca bir tür atom veya molekül içeren ve kimyasal bileşimi değişmeyen maddelerdir. Kimya biliminde saf maddeler, karışım olmayan, belirli bir yapıya ve özelliklere sahip olan maddelerdir. Saf maddeler, belirli fiziksel ve kimyasal özelliklere sahiptir ve bu özellikler, maddenin saflığına göre sabit kalır. Bu yazıda, saf madde örneklerine ve saf maddelerin özelliklerine detaylı bir şekilde göz atacağız.
Saf Madde Nedir?
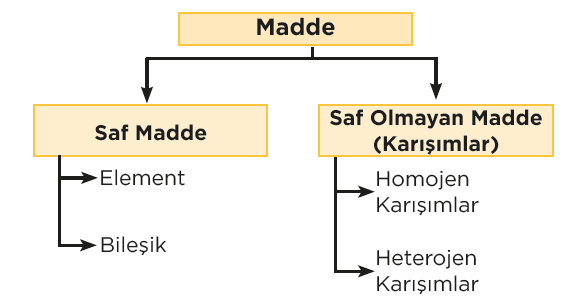
Saf madde, bileşiminde sadece tek bir tür atom veya molekül bulunan ve kimyasal açıdan homojen olan bir maddeyi ifade eder. Saf maddeler, özellikleri bakımından sabittir. Örneğin, saf suyun kaynama noktası 100°C’dir, çünkü suyun kimyasal bileşimi her zaman aynıdır. Saf maddeler genellikle iki ana kategoriye ayrılır: elementler ve bileşikler.
- Elementler: Yalnızca bir tür atomdan oluşan saf maddelerdir. Örneğin, oksijen (O₂), altın (Au) ve karbon (C) elementlerdir.
- Bileşikler: Farklı elementlerin belirli oranlarda birleşmesiyle oluşan saf maddelerdir. Örneğin, su (H₂O) ve karbon dioksit (CO₂) bileşiklerdir.
Saf Madde Örnekleri
1. Su (H₂O)
Su, saf bir bileşik örneğidir. Saf su, yalnızca su moleküllerinden oluşur ve herhangi bir yabancı madde içermez. Suyun kimyasal bileşimi sabittir ve her zaman H₂O formülüne sahiptir. Saf su, genellikle laboratuvar ortamlarında kullanılır ve yüksek saflıkta elde edilmesi önemlidir.
2. Oksijen (O₂)
Oksijen, atmosferde bolca bulunan bir elementtir ve saf bir madde olarak doğal halinde iki oksijen atomunun birleşmesiyle oluşur. Oksijen, canlıların solunumu için hayati önem taşır ve çeşitli endüstriyel süreçlerde de kullanılır. Kimyasal olarak, oksijen her zaman O₂ formülüne sahip olur.
3. Altın (Au)
Altın, doğal ortamda saf halde bulunabilen bir elementtir. Kimyasal bileşimi, sadece altın atomlarından oluşur ve genellikle mücevherat, para ve endüstriyel uygulamalar için kullanılır. Altın, özellikleri nedeniyle saf madde örnekleri arasında yer alır ve genellikle diğer elementlerle karışmadan bulunur.
4. Karbon (C)
Karbon, saf halde bulunan bir elementtir ve doğal olarak farklı formlarda bulunabilir, örneğin grafit, elmas veya kömür. Ancak saf karbon, her zaman yalnızca karbon atomlarından oluşur. Karbon, organik bileşiklerin yapı taşıdır ve çeşitli kimyasal reaksiyonlarda yer alır.
5. Karbon Dioksit (CO₂)
Karbon dioksit, karbon ve oksijenin birleşmesiyle oluşan bir bileşiktir. Saf karbon dioksit, genellikle endüstriyel uygulamalarda kullanılır ve atmosferde bulunan önemli bir gazdır. CO₂’nin kimyasal bileşimi sabittir ve atmosferdeki karışımında diğer gazlar bulunabilir, ancak saf karbon dioksit yalnızca CO₂ moleküllerinden oluşur.
6. Sodyum Klorür (NaCl)
Sodyum klorür, halk arasında tuz olarak bilinen saf bir bileşiktir. Sodyum ve klor elementlerinin birleşmesiyle oluşur ve suya karıştırıldığında çözünür. Yalnızca sodyum ve klor elementlerinin bileşimiyle oluşan bu madde, saf madde örneklerinden biridir.
7. Bakır (Cu)
Bakır, doğal olarak saf halde bulunan bir elementtir. Elektrik iletkenliği yüksek olduğu için genellikle elektrikli cihazlarda kullanılır. Bakır, kimyasal olarak yalnızca bakır atomlarından oluşur ve saf bakır, oksitlenmeden önce parlak kırmızımsı bir renge sahiptir.
8. Alüminyum (Al)
Alüminyum, saf halde bulunan bir elementtir ve genellikle metal endüstrisinde kullanılır. Hafif ve dayanıklı olması nedeniyle inşaat, otomotiv ve uçak endüstrisinde yaygın olarak tercih edilir. Saf alüminyum, yalnızca alüminyum atomlarından oluşur ve kimyasal özellikleri sabittir.
9. Azot (N₂)
Azot, atmosferde bulunan bir diğer saf gazdır. Azot molekülleri, iki azot atomunun birleşmesiyle oluşur ve saf azot, doğal haliyle gaz formunda bulunur. Azot, endüstriyel üretim süreçlerinde ve laboratuvarlarda kullanılır.
Saf Madde ile Karışım Arasındaki Fark
Saf madde ve karışım arasındaki farkı anlamak önemlidir. Karışımlar, birden fazla maddeyi içerir ve bu maddeler kimyasal bağlarla birleşmemiştir. Saf maddeler ise sadece tek bir bileşenden oluşur ve kimyasal özellikleri sabittir. Karışımlar, saf maddeler gibi belirli bir bileşime sahip değildir ve bileşenleri fiziksel yöntemlerle ayrılabilir.
Sonuç
Saf maddeler, kimya dünyasında önemli bir yer tutar. Elementler ve bileşikler olmak üzere iki ana gruba ayrılan saf maddeler, belirli bir bileşime ve kimyasal yapıya sahip olup, özellikleri her zaman aynıdır. Su, oksijen, altın, karbon, sodyum klorür gibi örnekler, saf madde örnekleri arasında yer alır. Saf maddeler, hem doğada hem de laboratuvar ortamlarında karşımıza çıkar ve çeşitli endüstriyel süreçlerde kullanılır.